 2021-06-22
2021-06-22 6592
6592
在当前的 SARS-CoV-2 大流行期间,病毒基因组中积累了多种突变,至少有五种变体被认为是对人类社会有害的 SARS-CoV-2 变体。新出现的 VOC B.1.617.2 谱系(Delta 变体)与 2021 年春季印度 COVID-19 的大规模激增密切相关,目前已成为最具威胁的新冠病毒变体。然而,目前其病毒学特性仍不清楚。
2021年6月17日,一篇名为“SARS-CoV-2 spike P681R mutation enhances andaccelerates viral fusion”的文章刊登在bioRxiv平台上,该研究表明:
1. Delta 变体是高度融合的并易形成合胞体的病毒株,刺突蛋白中的 P681R 突变在该谱系中高度保守。
2. 虽然 P681R 突变降低了病毒的传染性,但这种突变对中和抗体产生抗性。
3. 进一步的机制研究表明,P681R 突变促进了弗林蛋白酶(furin)介导的刺突蛋白(S蛋白)的切割,并加速了细胞-细胞融合。
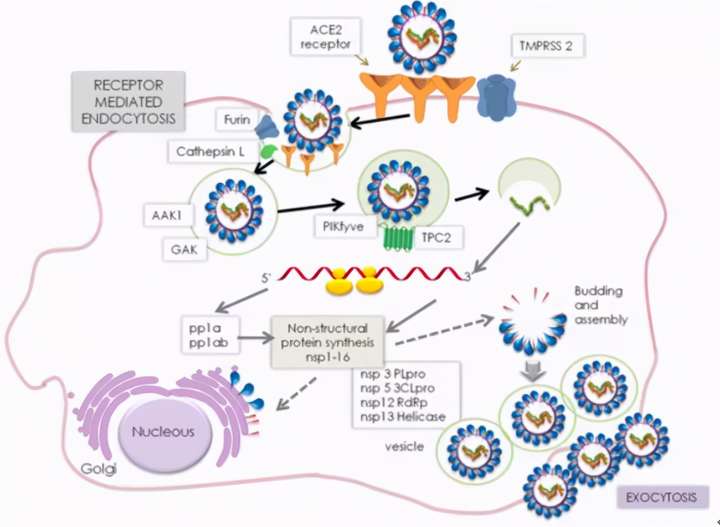
新冠病毒感染途径
新冠病毒感染过程:
第一步:病毒刺突糖蛋白(S蛋白)与宿主血管紧张素转化酶2(ACE2)受体的结合;
第二步,宿主跨膜丝氨酸蛋白酶2(TMPRSS2)对病毒刺突糖蛋白的切割融合;
第三步,病毒融合进宿主细胞膜。
Delta 变体可明显引起合胞体形成
通过对比变异病毒株B.1.617.1、B.1.617.2(Delta 变体)以及携带D614G的B.1.1分离株,研究者发现在Vero细胞中,B.1.617.1和B.1.617.2变体的生长显著低于B.1.1分离株。特别是,感染后48小时B.1.617变体的病毒RNA水平比B.1.1分离物低150倍以上。显微镜观察显示,感染这三种病毒的VeroE6/TMPRSS2培养物均有形成合胞体。值得注意的是,与B.1.1病毒相比,两种B.1.617病毒形成了更大的合胞体。通过测量感染VeroE6/TMPRSS2培养物中漂浮合胞体的大小,B.1.617.1和B.1.617.2(Delta 变体)感染形成的合胞体显著(2.3倍和2.7倍)大于B.1.1感染形成的合胞体。
这些结果表明与携带D614G的B.1.1病毒相比,B.1.617谱系(Delta 变体)更易形成合胞体,相对更喜欢细胞-细胞感染。

P681R突变是促进S蛋白介导融合的决定因素
P681R突变是B.1.617谱系(Delta 变体)的独特特征,该突变位于SARS-CoV-2 S蛋白的FCS(弗林蛋白酶断裂位点)附近。研究者通过反向遗传学产生了携带P681R的人工病毒,并进行了病毒学实验。制备的假病毒的Western印迹显示P681R突变显著增加了切割的S2亚单位的水平。用有或没有TMPRSS2表达的靶HOS细胞进行单轮假病毒感染试验。在没有TMPRSS2的情况下,携带P681R/D614G的假病毒的传染性与D614G假病毒的传染性相当。在TMPRSS2存在的情况下,与TMPRSS2空靶细胞相比,D614G假病毒的传染性增加了5.0-6.3倍。这些数据表明P681R突变在TMPRSS2存在的情况下减弱了无细胞病毒的感染性。
通过基于细胞的融合实验来研究P681R突变对病毒融合性的影响。在效应细胞(即S蛋白表达细胞)中,虽然D614G/P681R S蛋白表达水平与D614G S相当,但D614G/P681R突变体的断裂S2亚基水平显著高于D614G S2亚基。使用不含TMPRSS2的靶细胞进行的基于细胞的融合分析表明,D614G/P681R S的融合原性比D614G S高2.1倍,且初始融合速度比D614G S快2.8倍。这些数据表明P681R突变增强和加速了SARS-CoV-2 S介导的融合。
P681R突变对NAbs介导的抗病毒免疫具有抗性
中和试验的结果表明D614G/P681R人工病毒对针对SARS-CoV-2 S蛋白RBD的三种单克隆抗体具有部分(1.2-1.5倍)抗性。此外,用19份BNT162b2疫苗血清进行的中和试验表明,D614G/P681R人工病毒对疫苗诱导的NAbs具有显著的抗药性。
与针对无细胞病毒的中和活性相反,基于SARS-CoV-2 S融合实验(人工病毒和效应细胞(S-表达细胞)用NAbs或血清处理)表明,细胞-细胞感染对NAbs具有强烈的抵抗力,并且NAbs对细胞-细胞感染的不敏感性不依赖于P681R突变。
总之,这些发现表明P681R突变赋予了NAbs对无细胞病毒颗粒的抗性,与无细胞感染相比,细胞-细胞感染对NAbs介导的抗病毒作用具有抗性。
小结
自2019年12月新冠病毒爆发以来,已出现多种变异病毒株。2021 年春季印度出现的变异病毒株B.1.617(Delta 变体)因其具有中和抗体抗性引起了人们的广泛关注。
本文通过对B.1.617 变体的研究,确定了该谱系高度保守的P681R 突变。通过深入的研究发现,由于P681R 突变促进了弗林蛋白酶介导的刺突蛋白的切割,加速了细胞-细胞融合,促使B.1.617对中和抗体产生抗性。
版权声明:本文转自“生命科学前沿”,文章转载只为学术传播,不代表本号观点,无商业用途,版权归原作者所有,如涉及侵权问题,请联系我们,我们将及时修改或删除。
 学术互动
学术互动

添加微信获取最新优惠、出版政策、课程直播信息,随时咨询客服/编辑,了解更多实时资讯



