 2021-04-30
2021-04-30 6380
6380
2021年4月28日,华大基因,深圳大学,浙江大学,华中科技大学,西安交通大学,山西大学等单位在Nature 连续发表5项研究成果,生命科学,化学等领域取得重大进展,iNature系统介绍这5项研究成果:
【1】G蛋白偶联受体(GPCR)在细胞间通讯中具有重要作用。结构研究表明,GPCR可以激活G蛋白。但是,该机制在所有类型的GPCR中是否保守仍然未知。2021年4月28日,华中科技大学刘剑峰教授,浙江大学张岩及蒙彼利埃大学Jean-Philippe Pin共同通讯在Nature 在线发表了题为“Structural basis of GABAB receptor-Gi protein coupling”的研究论文,该研究报告C类异二聚体GABA B受体的结构,该结构由抑制性递质GABA激活,并以与Gi1蛋白复合的活性形式存在。该研究发现单个G蛋白与GABA B受体的GB2亚基在一个主要涉及跨膜结构域一侧的细胞内环2的位点相互作用。这与在其他类型的GPCR中观察到的中央腔室中G蛋白结合相反。这种结合模式是由于该GABA B受体的跨膜结构域的活性形式不同于其他GPCR的。该研究工作还提供了亚基间和亚基内变化的细节,连接激动剂与该异二聚体复合物中的G蛋白活化结合。总之,该研究系统地鉴定了C型异源二聚体GABAB受体与G蛋白复合物的高分辨率冷冻电镜结构,揭示了二聚体GPCR偶联G蛋白的新模式。
【2】2021年4月28日,哥本哈根大学,中国科学院昆明动物所及华大基因等多单位合作,张国捷团队在Nature 上在线发表了题为“Evolutionary and biomedical insights from a marmoset diploid genomeassembly”的研究论文,该研究提出了二倍体物种‘完美基因组’的新标准,即父母本两套基因组应完全独立组装到染色体水平。研究利用家系基因组测序数据,独立组装出人类疾病研究模型之一——普通狨猴(Callithrix jacchus)——父母本两套高质量的基因组,为进入“完美基因组”时代提供了一个范例。该工作是脊椎动物基因组项目的重要成果之一。同时该期Nature 杂志以封面形式报道了多篇来自该项目的其他文章。
【3】Asgard是最近发现的古细菌的超级菌种,似乎包括真核生物的最接近的古细菌亲属。关于真核生物的古细菌祖先是否属于Asgard超门之内还是该祖先是否是所有其他古细菌的姊妹群体(即两域生命树与三域生命树)的争论仍在继续。2021年4月28日,深圳大学李猛及美国NIH的Eugene V. Koonin共同通讯在Nature 在线发表题为“Expanded diversity of Asgard archaea and their relationships with eukaryotes”的研究论文,该研究对Asgard古细菌的162个完整或接近完整的基因组进行了比较分析,其中包括75个由超基因组组装的基因组,这些基因组以前没有被报道过。该研究结果大大扩展了Asgard的系统发育多样性,并提出了另外六个系统发育,包括一个深分支,将其命名为Wukongarchaeota。该研究使用162个Asgard基因组进行了全面的蛋白质结构域分析,导致真核签名蛋白集的重大扩展。 Asgard真核签名蛋白显示出可变的系统分布和域结构,这表明通过水平基因转移,基因丢失,基因重复和域改组而动态进化。Asgard古细菌的系统组学研究表明,通过广泛的水平基因转移,真核生物的古祖先(在Asgard内或外)中可移动的古细菌“ eukaryome”的成分积累。
【4】作为高或中熵合金(HEAs或MEA)的多种主要元素的复杂浓缩溶液正在成为理想解决方案的高组态熵。然而,在常温下,构成元素之间的焓相互作用也是预期的,从而导致不同程度的局部化学顺序。化学短程命令(CSRO)可以说是最难破解的证据,迄今为止,这些材料中CSRO的确凿证据已经丢失。2021年4月28日,西安交通大学马恩,中国科学院力学研究所武晓雷及清华大学朱静共同通讯在Nature 在线发表题为“Direct observation of chemical short-range order in a medium-entropy alloy”的研究论文,该研究使用适当的区域轴,微/纳米光束衍射,以及原子分辨率成像和通过透射电子显微镜进行的化学制图,可以在面心立方VCoNi浓缩溶液中明确显示CSRO。该研究配套的工具套件提供了有关CSRO程度,原子堆积结构以及化学物种对相邻晶格平面/位置的优先占有的具体信息。该研究的发现提供了一种识别浓熔合金中CSRO的方法。该研究还使用原子应变映射来证明CSRO增强了位错相互作用,从而阐明了这些CSRO对塑性机制和变形后力学性能的影响。
【5】分子量子气体(即超冷和致密分子气体)具有许多潜在应用,包括化学反应的量子控制,精确测量,量子模拟和量子信息处理。对于分子来说,要达到量子状态通常需要在高密度下进行有效冷却,这通常会因快速的非弹性碰撞而受阻,这会加热并耗尽分子。2021年4月28日,芝加哥大学,山西大学在Nature 在线发表题为“Transition from an atomic to a molecular Bose–Einstein condensate”的研究论文,该研究报告了通过在g波Feshbach共振附近的原子冷凝物中诱导配对相互作用而制备旋转分子的二维Bose-Einstein冷凝物(BEC)。该研究还探索了强耦合状态下的成对动力学,发现在Feshbach共振附近,动力学时标与单一性极限一致。另外,该研究的实验可能会揭示出具有轨道角动量的凝聚对,其中预测了一种新型的非零表面电流各向异性超流体,例如3He的A相。





G蛋白偶联受体(GPCR)是人体内最大的膜受体蛋白家族,其在细胞信号传导中发挥重要功能,同时也与人体疾病密切相关,是40%以上的上市药物的作用靶点1。根据结构和序列的差异性,人体中GPCR可分为A、B、C和F四种类型。近年来的结构功能研究分别揭示了A、B1、B2和F类以单体形式发挥功能的GPCP的激活机制2-5。
研究显示单体GPCR偶联G蛋白采用相似的模式,即受体的激活使跨膜结构域TM6的外移,进而形成较大的口袋用于结合Gα亚基的C末端,从而激活G蛋白下游信号通路。然而长期以来,以二聚化形式发挥功能的C型GPCR偶联G蛋白的分子机制一直未能揭示,严重阻碍了人们对C型受体信号转导机制的理解。
C型GPCR主要包括代谢型γ-氨基丁酸受体(GABAB)、代谢型谷氨酸受体(mGlu)、钙敏感受体(CaSR)和味觉受体1(Taste 1)等6。C型受体与众多神经和精神疾病相关,包括癫痫、疼痛、焦虑、抑郁、精神分裂症、药物成瘾、Rett综合征和癫痫性脑病等。GABAB受体是第一个被发现和证明的GPCR异源二聚体,是C型二聚体GPCR的典型代表7,8。
GABAB受体广泛表达在中枢神经系统中,参与学习、记忆和突触信号传递等重要的生理进程9。GABAB受体由GB1和GB2两个亚基组成,每个亚基分别由胞外结构域(VFT),七次跨膜域(TMD)和胞内域构成10。GABAB受体激活采取典型的非对称性调节机制,即GB1的VFT负责配体识别,而GB2的TM偶联Gi/o蛋白调控下游信号。
刘剑峰/张岩合作团队在2020年国际首次鉴定全长GABAB受体非激活态与激活态的精细三维空间结构,阐明了GABAB受体激活时的构象转变过程,鉴定了正向变构调节剂的结合口袋,极大地促进了GABAB受体的激活机制研究和靶向药物开发。同时,该工作还首次解析了低分辨的GABAB-Gi复合物结构,发现由于潜在的空间位阻,二聚化的GABAB受体仅能偶联一个G蛋白11。然而其非对称激活和偶联G蛋白的信号转导的分子机制还未被揭示。
本研究团队在前期工作的基础上再次进行课题攻关,先后突破复合物组装、均一冷冻样品制备、动态构象数据处理等挑战,最终完成高分辨GABAB受体-Gi蛋白复合物的电镜结构鉴定(图1a)。结构分析发现与单体GPCR不同,GABAB受体偶联G蛋白时,两个亚基跨膜域的TM6均没有发生外移,但是GB2亚基的TM3和TM5却发现较小幅度的外扩,使三个胞内环形成一个较浅的口袋结合G蛋白。与单体GPCR相比,G蛋白α5螺旋插入GABAB受体的深度低了~10Å,并且主要与胞内环互作。
这些结果结合以前的其他C型GPCR功能研究,推测C型GPCR二聚体都采用了这种不同于A、B1、B2和F类GPCP的激活的独特的G蛋白偶联模式(图1b-d)。
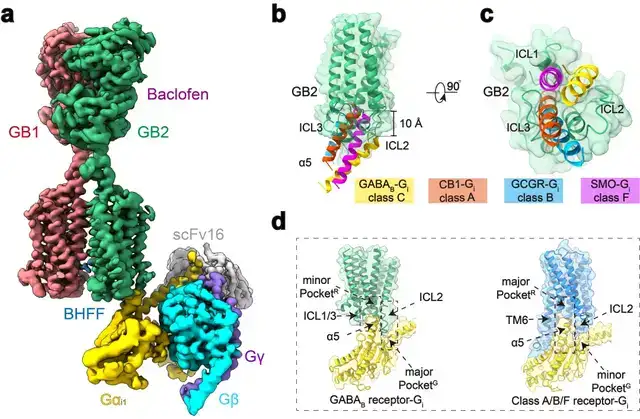
图1:GABAB偶联G蛋白复合物的新颖结构
此外,研究发现了GABAB偶联G蛋白后的精细构象变化,包括GB1和GB2之间的旋转,以及GB2亚基TM的细节变化。通过结构分析,研究人员发现结合激动剂的GABAB受体偶联G蛋白后,其GB2-TM相较于GB1-TM产生进一步的逆时针旋转,使得GB1和GB2的跨膜域界面进一步靠近,稳定激活状态。研究人员专注于GB2-TM的内部精细的构象变化,分析发现GB2 TM3/TM5胞内端的构象变化是起始于TM3上F586侧链苯环的大角度旋转。
信号转导实验分析发现,将F586突变成小侧链丙氨酸后,受体偶联G蛋白的能力显著下降。此外,在GB2-TM的底部,多个带电荷的氨基酸形成的盐桥进一步稳定了受体的激活态,从而揭示了GB2亚基结合G蛋白的结构基础(图2)。GB2亚基这些独特的构象的变化,最终决定了GABAB偶联G蛋白的非对称性激活模式。
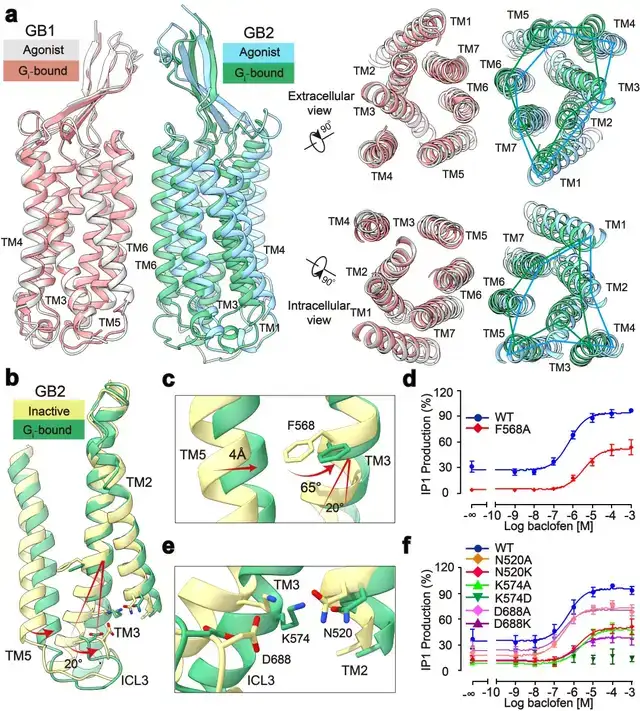
图2:GABAB受体采取非对称性变化的激活机制
GABAB主要通过3个胞内环偶联Gi蛋白:其中较长的ICL2主要与G蛋白上α5,αN,β2-β3的结合,占据了约80%的互作界面;而较短的ICL1、ICL3主要与G蛋白的α5末端几个氨基酸相互作用,稳定了G蛋白的结合(图3a,b)。此外研究发现GABAB受体选择性识别Gi/o亚型G蛋白是由于Gi/o的H5.23位点是小侧链的半胱氨酸,而Gs、Gq等类型G蛋白的相应位置大侧链的酪氨酸与GABAB受体具有潜在的空间位阻(图3c)。
功能实验分析发现,当把H5.23位点的半胱氨酸突变成大侧链的色氨酸后,其偶联G蛋白的能力显著降低,而当突变成小侧链的丙氨酸后,其结合G蛋白的能力没有变化(图3d,e)。
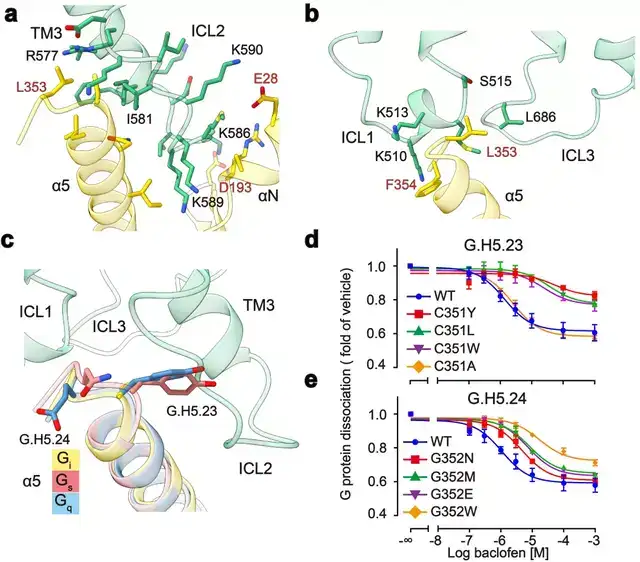
图3:GABAB受体选择性偶联Gi蛋白的分子机制
该项工作完整地阐述了C型异源二聚体GABAB受体的非对称激活机制:在非激活状态下,GABAB受体两个亚基的VFT区都处于开放状态,TM区采用TM3-TM5/TM3-TM5互作界面;激动剂结合GB1-VFT正位口袋后,诱导GB1-VFT闭合,从而使得GB2-VFT旋转,进一步由颈区传导至TM结构域的重排,形成新的TM6/TM6作用界面;PAM以及G蛋白的结合,进一步诱导了GB2的TM区的旋转,形成更稳定的TM6/TM6互作界面;此外GB2亚基F568等残基精细的构象变化,导致其TM3/TM5的胞内端外移,三个胞内环形成较浅的口袋选择性偶联Gi/o蛋白,最终激活下游信号通路(图4)。
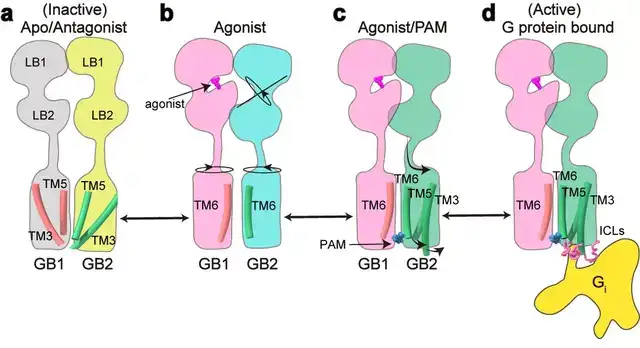
图4:GABAB受体激活的信号转导模型
本研究是浙江大学—华中科技大学细胞信号转导联合实验室在C型GPCR信号转导机制研究中的又一重大突破。该工作也进一步验证了刘剑峰课题组之前发现的C型GPCR二聚体,如代谢型谷氨酸受体(Nat Chem Biol.,2015; PNAS., 2011),GABAB受体(Cell Research,2020; Nat Commun.,2019;EMBO J.,2008)和钙敏感受体(PNAS.,2020)中不同亚基的各个功能域变构调节的激活模式。
华中科技大学与浙江大学医学院联合培养博士生申仓松、浙江大学医学院附属邵逸夫医院毛春友研究员、华中科技大学教师许婵娟和博士生晋楠为本研究第一作者。华中科技大学生命科学与技术学院刘剑峰教授,浙江大学医学院张岩研究员和法国功能基因研究所PIN JP教授为共同通讯作者。
浙江大学医学院蛋白质平台、冷冻电镜中心为本次研究的样品制备和数据收集提供了支持。该工作也得到了浙江中医药大学陈忠教授,浙江大学药学院侯廷军教授和法国功能基因研究所Rondard P教授的协助。本工作得到了科技部国家重点研发计划、国家自然科学基金等项目的大力支持。
版权声明:本文转自“iNature”,文章转载只为学术传播,不代表本号观点,无商业用途,版权归原作者所有,如涉及侵权问题,请联系我们,我们将及时修改或删除。
WOSCI沃斯编辑,耶鲁大学博士团队匠心打造,专注最新科学动态并提供各类科研学术指导,包括:前沿科学新闻、出版信息、期刊解析、论文写作技巧、学术讲座、SCI论文润色等。
 学术互动
学术互动

添加微信获取最新优惠、出版政策、课程直播信息,随时咨询客服/编辑,了解更多实时资讯



